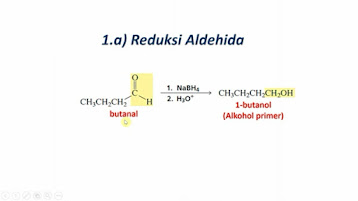
Derivat Asam Karboksilat

Derivat asam karboksilat di dapat jika kita memindahkan grup hidroksida pada asam karboksilat ke grup yang berbeda. Apabila kita mengganti grup hidroksida dengan halogen contohnya dengan cl maka akan dihasilkan asam halida. Jika kita mengganti hidroksida dengan oksigen lalu ikatan karbon ganda dengan oksigen dan grup R yang kedua,maka senyawa ini dinamakan asam anhidrida.Jika kita mengganti gugus hidroksida dengan grup OR dan ini dinamakan dengan ester. Lalu jika kita mengganti gugus hidroksida dengan nitrogen contohnya NH2,dinamakan amida. Asam karboksilat terdiri dari ikatan ganda antara karbon dengan oksigen. Lalu bagaimana jika terdapat beberapa ikatan ganda dari karbon. Jika kita menghilangkan oksigen yang berikatan dengan karbon dan karbon memiiliki ikatan rangkap 3 dengan nitrogen,senyawa ini dinamakan nitril. Apabila kita melihat ikatan siklik dan terdapat ikatan ganda karbon dengan oksigen lalu pada ikatan kedua terdapat oksigen maka senyawa i...