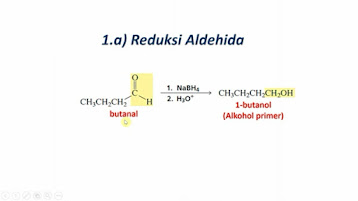
Reaksi Pembentukan dan Sifat-Sifat Asam Karboksilat

1. Sifat-Sifat Asam Karboksilat Rumus umum asam karboksilat adalah RCOOH,senyawa asam karboksilat bersifat polar dikarenakan atom C lebih elektropositif dibandingkan atom O,pada atom O yang berikatan dengan atom hidrogen memiliki 2 pasangan elektron bebas sehingga jika direaksikan maka akan dapat membentuk ikatan hidrogen antar sesamanya. Dua molekul asam karboksilat akan saling terhubung membentuk 2 ikatan hidrogen yang disebut dengan asam karboksilat sebagai dimer. Dapat dilihat dari gambar berikut: Ikatan hidrogen yang terbentuk adalah 2 ikatan hidrogen (dimer) sehingga ikatan hidrogen dari asam karboksilat termasuk ikatan hidrogen yang kuat. Dikarenakan ikatan yang kuat tersebut asam karboksilat memiliki titik didih yang lebih tinggi daripada alkohol. Pada senyawa asam karboksilat,semakin sedikit atom C pada senyawa asam karboksilat maka sifat kepolaran asam karboksilat akan meningkat,contohnya asam format,asam asetat,propanoat memiliki ...